Vzácné plyny
-
Exkluzivní obsah a nové články najdete na HeroHero, ale je nutné být přihlášený. O čem mé HeroHerou je najdete zde (Jenom pro ty, kteří chtějí jít dál.)
-
YouTube - Alchymistka - Tania's Secret - obsah zdarma
-
Facebooková stránka: Tania's Secret: Papoušek mezi světy
-
Pojem Hermetická homeopatie používám jako označení vlastního výzkumného směru v oblasti homeopatie.

Přehled od AI
Vzácné plyny, také známé jako inertní plyny, jsou skupina chemických prvků, které se vyznačují malou reaktivitou.
Jsou to helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) a radon (Rn). T
yto plyny jsou obvykle bezbarvé, bez chuti a zápachu a nacházejí se v zemské atmosféře v malém množství.
Základní vlastnosti:
Chemická inertnost: Vzácné plyny mají plně obsazený elektronový obal, což jim dává vysokou stabilitu a nízkou reaktivitu.
Monoatomické molekuly: Vyskytují se v přírodě jako jednoatomové molekuly.
Nízké teploty varu: Mají nízké teploty varu, což znamená, že se snadno zkapalňují.
Zářivý efekt: Za určitých podmínek vykazují charakteristické záření v elektrickém výboji.
Použití:
Vzácné plyny mají široké spektrum využití, například:
- Osvětlení: Helium, neon, argon, krypton a xenon se používají v různých druzích výbojek a zářivek.
- Svařování: Argon se používá jako inertní plyn při svařování kovů, jako je hliník a hořčík.
- Lékařství: Radon se dříve používal k léčebným účelům, ale dnes se spíše využívají jiné formy terapie.
- Anestezie: Xenon se používá jako anestetický plyn.
- Chlazení: Helium se používá jako chladivo v nízkoteplotních aplikacích.
Rozdělení podle reaktivity:
Lehké vzácné plyny (He, Ne, Ar):
- Jsou velmi málo reaktivní a tvoří sloučeniny jen za velmi specifických podmínek.
Těžké vzácné plyny (Kr, Xe, Rn):
- Mají mírně vyšší reaktivitu a jsou schopny tvořit některé sloučeniny s elektronegativními prvky, jako je fluor a kyslík.
Objevy vzácných plynů:
- Helium bylo objeveno nejprve ve slunečním spektru a poté ve vulkanických plynech.
- Ostatní vzácné plyny (neon, argon, krypton, xenon) byly objeveny v atmosféře.
- Radon byl objeven jako produkt radioaktivního rozpadu.
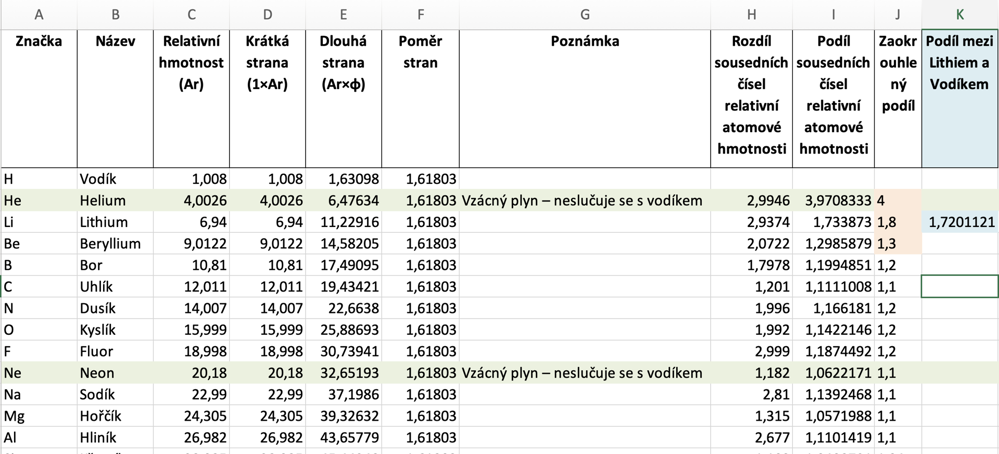
Hélium - když se podíváte do tabulky, je prostě tak nějak mimo hodnoty těch ostatních ;)
Základní fakta o héliu (He)
Protonové číslo: 2
Elektronová konfigurace: 1s²
Skupina v periodické tabulce: 18 (vzácné plyny / inertní plyny)
Fyzikální stav při běžných podmínkách: plyn
Bezbarvý, bez chuti, bez zápachu, nehořlavý
Nejnižší bod varu ze všech prvků: −268.93 °C
Nereaktivní (chemicky inertní)
Co činí hélium tak výjimečným?
1. Je lehčí než většina plynů a uniká ze Země
- Je druhý nejlehčí prvek po vodíku.
- Gravitačně ho Země nedrží dobře — uniká do vesmíru.
- Proto je na Zemi poměrně vzácné a vzniká hlavně při radioaktivním rozpadu v zemské kůře.
2. Je to jediný z plynů, který se při ochlazení nestane pevným za běžného tlaku
- Supertekutost: kapalné hélium při teplotách blízko absolutní nuly (zejména izotop He-4) se chová jako superfluidum – dokáže téct bez tření, vylévat se přes stěny nádob.
- Tohle dělá jen hélium. Fyzikální anomálie.
3. Elektronová konfigurace, která nezapadá do šablony
- I když má jen s-orbitál (1s²), je umístěn ve skupině 18 (která jinak obsahuje prvky končící elektronovou konfigurací ns²np⁶).
- Formálně by se dal dát i do skupiny 2 (alkalické kovy) podle elektronové konfigurace — ale tam rozhodně nepatří chemicky.
- Zkrátka ho tam dali "z nutnosti" kvůli podobnosti vlastností s ostatními inertními plyny.
4. Je téměř úplně nereaktivní
- Netvoří stabilní sloučeniny za běžných podmínek.
- Zatímco xenon a krypton se za extrémních podmínek vázat mohou (např. xenonfluoridy), hélium tvoří jen velmi nestabilní a exotické sloučeniny (např. HeH⁺) – které jsou spíše laboratorními kuriozitami nebo je najdeme v mezihvězdném prostoru.
5. Kosmologický význam
- Druhý nejrozšířenější prvek ve vesmíru (po vodíku).
- Vzniklo už při velkém třesku (tzv. primordiální hélium) a dále vzniká v nitru hvězd při fúzi vodíku.
6. Neobvyklé využití
- Nehoří – používá se v balonech místo vodíku.
- Využití ve výzkumu, kryogenice, jaderné fúzi, MRI přístrojích, hlubokomořském dýchání (He-O₂ směsi), při detekci netěsností, v laserové technice atd.
Metafyzická nebo filozofická zvláštnost?
Hélium by se dalo označit za prvotní substanci klidu a čistoty:
- Neinteraguje – jako by bylo nevtělené do světa reakcí.
- Nepodléhá běžným pravidlům chování (např. nepřechází do pevného skupenství).
V duchovní symbolice by mohlo představovat stav „za myslí" – čisté vědomí bez reakce, bez pout.
Jak se vzácné plyny spojují na Zemi?
? Argon (Ar)
Je chemicky velmi inertní.
Nejsou známy žádné stabilní sloučeniny za běžných podmínek.
Argon fluorohydrid (HArF) – byl připraven v kryogenních podmínkách (přesněji: 8 K = -265 °C).
Jinak se používá jako inertní atmosféra pro svařování, žárovky, nebo jako ochrana před oxidací.
? Krypton (Kr)
Reaguje s fluorem: např. KrF₂ (krypton difluorid).
Je možné ho ionizovat a vázat za extrémních podmínek.
V laboratoři použitelný, ale v přírodě je reaktivita mizivá.
? Xenon (Xe) – rebel mezi vzácnými plyny
Tvoří stabilní sloučeniny:
XeF₂, XeF₄, XeF₆ (fluoridy)
XeO₃, XeO₄ (oxidace xenonu)
Dokonce existují xenonové kyseliny a xenonové soli.
Zde se ukazuje, že i „inertní" plyn může být reaktivní, když má dostatečně velké atomové jádro → polarizovatelnost valenční obálky.
? Radon (Rn) – radioaktivní záhadák
Málo prozkoumaný, kvůli své radioaktivitě (rozpadá se na polonium).
Teoreticky mohl by tvořit fluoridy (např. RnF₂), ale stabilita je nízká.
Využívá se (nebo se využíval) v medicíně při ozáření (radioterapii), dnes se mu však lidé spíš vyhýbají.
Nebezpečný v domech: uvolňuje se z hornin a může se hromadit v uzavřených prostorech → karcinogen.
Co rozhoduje o jejich schopnosti se spojit?
Velikost atomu (čím větší, tím lépe lze polarizovat elektronový obal).
Dostupnost vysokého oxidačního stavu (Xenon může mít +2 až +8).
Fluor jako nejvíce elektronegativní prvek → jediný, kdo je schopen „vnutit" se inertním plynům.
Zajímavost: Proč hélium, neon a argon tak urputně odolávají?
Mají malé atomové jádro + úplně zaplněné s (neon) a p (argon) orbitaly → není kam sáhnout.
Malý průměr + vysoká ionizační energie = „žádný přístup" pro vazbu.





